
取消
清空記錄
歷史記錄
清空記錄
歷史記錄



和AVT一起聊一聊美國DMF的那些事兒
?本文內(nèi)容分享自藥聯(lián)播《一文講透美國DMF》
?AVT小編想和大家聊一聊美國DMF,說起活性物質(zhì)主文件,美國DMF制度是首創(chuàng),歐洲以及其他后續(xù)的加拿大、澳大利亞等,都是在仿美國的DMF制度。
?前言
?筆者在查資料的過程中發(fā)現(xiàn),歐洲的ASMFs最初的討論文件是在2006年,CEPs最開始的起源,也得到2001年(EDQM是根據(jù)2001/83 EC指令來進(jìn)行CEPs認(rèn)證的)。而美國的DMF指南,1989年就開始實(shí)施了,并且一直延續(xù)到現(xiàn)在。說起活性物質(zhì)主文件,美國DMF制度是首創(chuàng),歐洲以及其他后續(xù)的加拿大、澳大利亞等,都是在仿美國的DMF制度。
?DMF制度確實(shí)是一個(gè)創(chuàng)新,對活性物質(zhì)、輔料、藥包材的生產(chǎn)商(DMF的持有者)、FDA和制劑上市申請者都有好處:一是活性物質(zhì)或輔料或藥包材的生產(chǎn)商只需要向FDA遞交資料,不需要把資料給制劑上市申請者,這樣保護(hù)了活性物質(zhì)或輔料或藥包材的生產(chǎn)商的商業(yè)機(jī)密。二是不同制劑上市申請者用到相同的DMF,F(xiàn)DA也不需要多次審評,節(jié)約了審評資源。三是對制劑上市申請者來說可以把主要精力放在制劑上。所以介紹活性物質(zhì)的主文件,不得不介紹美國DMF制度。
?DMF簡介
?一套DMF(Drug Master File)文件是遞交給FDA的,包含在生產(chǎn)、操作、包裝和儲(chǔ)存一個(gè)或多個(gè)人用藥過程中,使用到的廠房,操作流程或使用的物質(zhì)的保密細(xì)節(jié)信息。DMF不是法律法規(guī)要求遞交的,而是企業(yè)決定要不要遞交。DMF包含的內(nèi)容可支持: 臨床研究申請(Investigational New Drug, IND), 新藥注冊(New Drug Application,NDA) 和仿制藥注冊(Abbreviated New Drug Application, ANDA), 另一個(gè)DMF,或是出口申請注冊(Export Application),以及這些申請注冊的變更或是補(bǔ)充申請。
?DMF注冊
?DMF有五種類型,其中:2000年后,I型DMF FDA已不再接受。
?I 型:組織與人員、設(shè)施與設(shè)備和標(biāo)準(zhǔn)操作程序;
?II型:原料藥、中間產(chǎn)品及其原料,制劑藥;
?III型:包裝材料——容器;
?IV型:賦形劑,著色劑,香料及其原料;
?V型:可被FDA接受的其它信息;
?DMF的狀態(tài)分成兩種,
?“A”=active:激活狀態(tài),意味著DMF可用,沒有關(guān)閉;
?“I”=Inactive:未激活狀態(tài),意味著DMF被DMF持有者或FDA關(guān)閉。
?重新激活DMF
?未激活的DMF(或是關(guān)閉的DMF)想變成激活狀態(tài),只能通過遞交激活申請來激活。激活申請應(yīng)包含一整套DMF文件,并符合現(xiàn)行法規(guī)。封面信必須注明是激活申請。或者DMF持有者可以遞交一個(gè)新的DMF。
?FDA每個(gè)季度對DMF的列表清單進(jìn)行更新,可在官網(wǎng)找到Excel版和TXT版的列表。目前DMF清單是2016年6月30日之前收到的文件,確認(rèn)接受信函(acknowledgment letters)在2016年7月6號(hào)之前發(fā)出。
?筆者對這份列表進(jìn)行了統(tǒng)計(jì)分析,截止2016年第二季度,總有29414份DMFs,其中52%屬于未激活狀態(tài)。
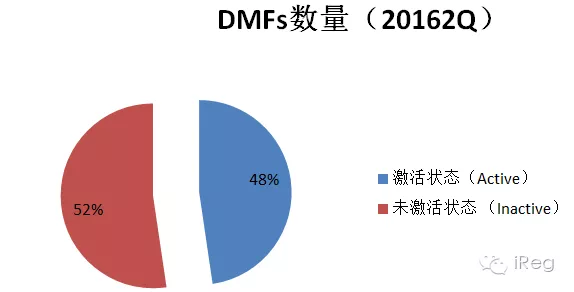
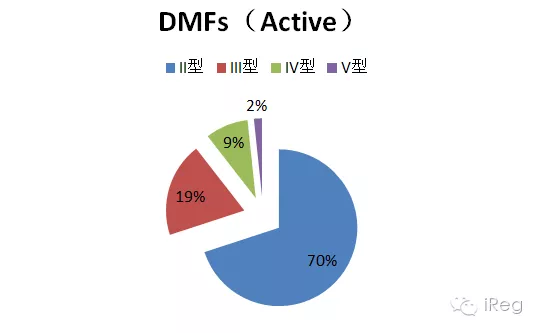
?注:被取消的DMF號(hào),預(yù)分配的DMF號(hào)和待定或是被分配到其他中的DMF號(hào)不在DMF清單中。DMF狀態(tài)不傳達(dá)其他信息,例如DMF是否技術(shù)審評過,或者是不是正在進(jìn)行完整性審評(Completeness Assessment); 如想詢問DMF是不是在完整性審評中,可發(fā)送郵件至DMFOGD@fda.hhs.gov, 進(jìn)行詢問。 在激活的DMF中,II型DMF最多,占有70%;V型最少,占2%;
?DMF的注冊格式
?雖然目前為止,DMF沒有要求用電子版,但到2017年5月份后,新遞交的DMF都要用eCTD格式遞交;如果不用eCTD格式遞交,將會(huì)被CDER拒收。之前一直都用紙質(zhì)遞交的DMF,沒有強(qiáng)制要求使用eCTD格式。
?電子版的DMF可通過FDA的ESG遞交(Eelectronic Submission Gateway). 10GB以下的注冊資料都可通過ESG遞交,大部分DMF都不超過10GB;FDA鼓勵(lì)DMF持有者盡早獲得ESG的賬號(hào)。對于超過10GB的注冊資料,可用物理媒介遞交,例如光盤等。
?在2017年5月份之前,任何時(shí)候,DMF持有者均可選擇從目前的紙質(zhì)DMF轉(zhuǎn)到eCTD格式。如果DMF持有者決定轉(zhuǎn)成eCTD格式,DMF號(hào) (DMF number)將保持不變。如果DMF號(hào)之前是4位數(shù)的,要轉(zhuǎn)成eCTD格式,需在前面補(bǔ)充兩個(gè)00,達(dá)到6位數(shù)。例如,紙質(zhì)版時(shí),DMF號(hào)是1234,轉(zhuǎn)成eCTD時(shí),DMF號(hào)位001234;此外,DMF持有者決定轉(zhuǎn)成eCTD格式,如果因?yàn)楦袷降霓D(zhuǎn)變,DMF的內(nèi)容需要調(diào)整變更,這些調(diào)整和變更需要在封面信(Cover Letter)上寫清楚。
?2017年5月之前,對現(xiàn)行紙質(zhì)版DMF的注冊資料,需要兩份紙質(zhì)版;如果有DVD或CD和紙質(zhì)版的注冊資料一起遞交,DVD或是CD不被接受。通過e-mail遞交的注冊資料也不被接受。紙質(zhì)版的注冊資料可以雙面打印。
?預(yù)分配DMF號(hào)
?DMF持有者希望電子遞交DMF文件必須事先獲取一個(gè)DMF預(yù)分配號(hào)。紙質(zhì)遞交DMF的持有者也可獲取。
?公司如果想獲得V型的DMF號(hào),應(yīng)獲得DMF的清晰理由(Clearance);如果沒有獲得Clearance,在申請獲得DMF號(hào)時(shí),應(yīng)在說明清楚DMF所包含的內(nèi)容,例如無菌處理設(shè)施申請中CMC(Chemistry, Manufacturing and Controls)部分的資料編寫格式。
?DMFs應(yīng)該根據(jù)CTD格式來編寫。MaPP(Manual of Policies and Procedures) 中包含了審評者的職責(zé)。審評者按照Question-based Review(QbR) format 來審評。所有II型DMF中的原料藥和制劑部分,也可參考QbR格式來寫,盡管這并不是要求。
?轉(zhuǎn)成CTD格式
?公司可能把現(xiàn)行的紙質(zhì)的、非CTD格式的文件轉(zhuǎn)成紙質(zhì)的CTD格式。在這種情況下,建議DMF持有者遞交補(bǔ)充申請,包含所有CTD格式中的section,這些內(nèi)容在之前的非CTD格式中也都包含。每個(gè)部分的信息都應(yīng)該是完整的和zui新的。對于原料藥(drug substance)和輔料需要遞交3.2.S和2.3.S模塊的資料。對于制劑,需要遞交所有3.2.P和2.3.P模塊資料。如因格式改變引起了DMF技術(shù)文件的變化,例如增加新的信息,新格式注冊的封面信應(yīng)說明哪些技術(shù)方面有改變。
?溝通渠道
?1) 所有DMFs的問題或意見可發(fā)送至dmfquestion@cder.fda.gov,除非DMFs在GDUFA下的問題的,這方面的問題可發(fā)郵件至:DMFOGD@FDA.hhs.gov
?2) 所有的問題,在郵件的subject 上需要寫清楚,郵件的大概內(nèi)容以及與DMFs的關(guān)系.因?yàn)猷]箱經(jīng)常受到大量的垃圾郵件,郵件subject是空白的或無意義的文字或只有一個(gè)問號(hào),郵件將不會(huì)被打開。
?3)如果詢問某個(gè)具體的DMF,DMF號(hào)需要包含在郵件的subject中。
?4)其他關(guān)于DMF的問題,應(yīng)發(fā)送到CDER-OPQ-Inquiries@fda.hhs.gov.
?5) 關(guān)于詢問報(bào)告的分類(reporting category)和批準(zhǔn)了的申請中DMF有變更的問題,也應(yīng)發(fā)送到上面的郵箱。
?DMF審評
?行政審評(Administrative Review)
?FDA的文件室(document room)收到任何注冊資料,包括DMF文件,都不會(huì)發(fā)出收到通知。收到資料后,原始的DMF文件進(jìn)行行政審評,看看資料形式上是否是完整的。行政審評可能需要2-3周。如果DMF文件通過了行政審評,F(xiàn)DA會(huì)發(fā)出確認(rèn)函(Acknowledgement Letter),通知DMF持有者DMF號(hào)。這之后,DMF的狀態(tài)是激活的。如果沒有通過行政審評,F(xiàn)DA將會(huì)通知DMF持有者DMF有哪些缺陷,這些缺陷修正后,DMF的狀態(tài)才能變成激活。
?技術(shù)審評 (Technical Review)
?DMFs只有在下面情況下,才進(jìn)入技術(shù)審評:
?1. DMF是激活狀態(tài).
?2. DMF持有者遞交了一式兩份授權(quán)信(Letter of Authorization, LOA)(如果是紙質(zhì)版遞交);如果DMF是按照CTD格式來寫的,無論是電子版還是紙質(zhì)版,LOA應(yīng)該包含在section 1.4.1中。LOA中應(yīng)包含DMF號(hào)(DMF number).
?3.DMF持有者遞交一份LOA給授權(quán)方(一般為制劑生產(chǎn)者)。
?4.授權(quán)方遞交注冊資料給FDA,注冊資料中包含復(fù)制的LOA。復(fù)制的LOA應(yīng)包含在section 1.4.2中。
?完整性審評 (Complete Assessment)
?在GDUFA (Generic Drug User Fee Action, 仿制藥付費(fèi)者法案 )中規(guī)定支持仿制藥申請的 II型DMF才需要進(jìn)行完整性審評。參見指南”Completeness Assessments for Type II API DMFs Under GDUFA”(CA Guidance);
?仿制藥付費(fèi)者法案包括了DMF費(fèi)用條款,完整性審評以及和DMF持有者的交流。GDUFA只適用于支持ANDA申請的原料藥(Active Pharmaceutical Ingredients, APIs)II型DMF。GDUFA中不適用于的II型DMF,如下:
?其他種II型,IV型和V型的DMF;
?其他II型DMFs:
?僅支持NDAs或INDs;
?API中間體
?APIs制備過程中的物質(zhì)
?制劑中間體
?制劑
?通過完整性審評的DMFs有個(gè)Excel表格可以查詢,在FDA網(wǎng)站上可以找到。只有在這張表格中找到的DMFs才通過了完整性審評。目前這個(gè)excel表格每周更新一次。
?GDUFA下的II型DMF通過行政性審評(Administrative Review)并且已經(jīng)按照符合相關(guān)規(guī)定,將會(huì)排隊(duì)等待完整性審評。完整性審評不需要LOA。完整性審評所需要的時(shí)間要看工作量,可能需要很多周。
?注:審評時(shí)DMFs文件應(yīng)該是zui新的,根據(jù)DMFs法規(guī)(21CRF 314.420(c)):
?任何增加,改變或刪除DMFs的文件(除非是此法規(guī)中paragraph(d)中規(guī)定的) 都需遞交一式兩份資料,并寫上所影響的DMF的名稱、參考號(hào)(reference number)、卷號(hào)和頁碼信息。
?DMF指南文件建議DMF持有者一年更新一次DMFs。為了確保DMFs文件是zui新的,F(xiàn)DA發(fā)出逾期通知信函(Overdue Notification Letter, ONLs)給DMF持有者,如果DMF持有者在過去36個(gè)月都沒有遞交年報(bào)。如果DMF持有者在90天內(nèi),沒有對FDA的逾期通知函回復(fù),F(xiàn)DA將會(huì)關(guān)閉DMF。
?各類型DMF相關(guān)指南
?I型
?從2000年后,不再接受I型DMFs。II型、III型和IV型DMFs不需要把設(shè)備、人員或是總體的操作流程包含在DMFs里面。只需要包含DMF持有者的地址、生產(chǎn)地址和聯(lián)系人的地址信息等。
?II型 原料藥和原料藥中間體
?參考指南
?1)"Guidance for ?Industry M4Q: The CTD - Quality".
?2)Guidance for Industry: ANDAs: ?Stability Testing of Drug Substances and Products: Questions and Answers DRAFT GUIDANCE
?3) GDUFA
?4) ICH 指南:Q11 Development and Manufacture of Drug Substances
?III型 包裝材料—容器
?參考指南
?1)Guidance for Industry: Container Closure Systems for Packaging Human Drugs and Biologics: Chemistry, Manufacturing, and Controls Documentation
?2)MAPP 5015.5 ?CMC Reviews of Type III DMFs for Packaging Materials
?III型DMF應(yīng)用CTD格式來編寫。單個(gè)的部件(Single components)和構(gòu)建材料(materials of construction) 應(yīng)按照原料藥格式來編寫。例如,生產(chǎn)制造過程應(yīng)包含在S.2里面。組裝的包裝系統(tǒng)(Assembled container closure systems)可作為制劑的格式來寫,例如構(gòu)建材料可寫在P.1里面 (3.2.p.1: description and composition of the drug product), 最終包裝材料的放行標(biāo)準(zhǔn)可包含在P.5(3.2.P.5: control of drug product)中。
?IV型:賦形劑,著色劑,香料及其原料
?參考指南
? 1)DMF Guidance ?
?2)Guidance for Industry: Nonclinical Studies for the Safety Evaluation of PharmaceuticaExcipients”(如有毒理研究的CMC信息包含在IV型的DMF中)
?IV型DMF如只包含單一的物質(zhì),可用CTD中原料藥的格式來寫;如包含的是混合物,例如香料的混合物,可用CTD中的制劑格式來寫。如果資料中包含毒理研究的CMC信息,毒性研究的CMC信息應(yīng)包含在另外的一卷或幾卷中。盡管zui好是把獨(dú)立研究的CMC信息作為V型DMF來遞交。在電子遞交的輔料DMF中,關(guān)于毒性研究的信息應(yīng)該包含在合適的模塊中。
?V型:可被FDA接受的其它信息
?參考指南
?1)21 CFR 314.420(a)
?2)Guidance ?for Industry for the Submission Documentation for Sterilization Process Validation in Applications for Human and Veterinary Drug Products
?根據(jù)法令,DMF持有者如果想申請V型DMF,必須給FDA清晰的理由(obtain clearance from FDA)(除了上述第二個(gè)指南中的無菌處理設(shè)施)。潛在的V型DMF持有者應(yīng)該將他們的請求發(fā)送到dmfquestion@cder.fda.gov,
?包括下面的內(nèi)容:
?1. 申請V型DMF的必要性
?2. 擬定的DMF名稱
?3. 這些信息不能包含在IND,NDA或是ANDA中的理由
?




 瀏覽器自帶分享功能也很好用哦~
瀏覽器自帶分享功能也很好用哦~




